实验室安全教育宣传——生物安全教育
生物安全是指避免危险生物因子造成实验室人员伤害,或避免危险生物因子污染环境,危害公众的综合措施。在国内外发生过许多惨痛的生物安全事故,造成了生命财产的重大损失,所以,预防和控制自身感染,加强生物实验室的安全学习至关重要。
一、生物安全实验室分级
生物安全实验室:具备生物安全防护能力的实验室,分为4级。
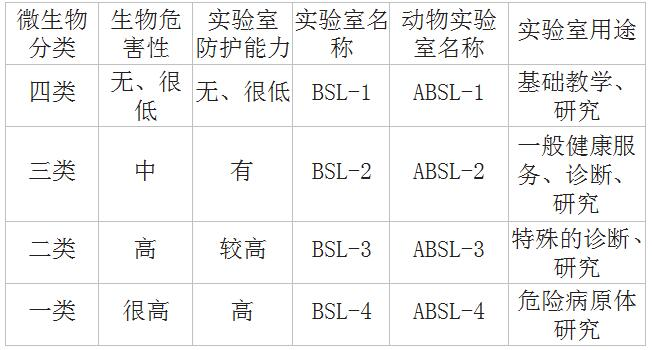
二、生物实验室的安全操作
(一)标本容器的相关操作
标本容器可以是玻璃的,但最好使用塑料制品。标本容器应当坚固,正确地用盖子或塞子盖好后应无泄漏。在容器外部不能有残留物。容器上应当正确地粘贴标签以便于识别。标本的要求或说明书不能够卷在容器外面,而是要分开放置,最好放置在防水的袋子里。
打开包装接收和打开标本的人员应当了解标本对身体健康的潜在危害,并接受过如何采用标准防护的培训,尤其是处理破碎或泄漏的容器时更应如此。标本的内层容器要在生物安全柜内打开,并准备好消毒剂。
(二)移液管和移液辅助器的使用
1.应使用移液辅助器,严禁用口吸取。
2.所有移液管应带有棉塞以减少移液器具的污染。
3.不能向含有感染性物质的溶液中吹入气体。
4.感染性物质不能使用移液管反复吹吸混合。
5.不能将液体从移液管内用力吹出。
6.刻度对应(Mark-to-mark)移液管不需要排出最后一滴液体,因此最好使用这种移液管。
7.污染的移液管应该完全浸泡在盛有适当消毒液的防碎容器中。移液管应当在消毒剂中浸泡适当时间后再进行处理。
8.盛放废弃移液管的容器不能放在外面,应当放在生物安全柜内。
9.有固定皮下注射针头的注射器不能够用于移液。
10.在打开隔膜封口的瓶子时,应使用可以使用移液管的工具,而避免使用皮下注射针头和注射器。
11.为了避免感染性物质从移液管中滴出而扩散,在工作台面应当放置一块浸有消毒液的布或吸有消毒液的纸,使用后将其按感染性废弃物处理。
12.受污染的移液管放在适宜的消毒剂中浸泡和高压消毒锅中消毒灭菌,再用自来水冲洗及去离子水冲净。
(三)避免感染性物质的扩散
1.为了避免被接种物洒落,微生物接种环的直径应为2~3mm并完全封闭,柄的长度应小于6cm以减小抖动。
2.使用封闭式微型电加热器消毒接种环,能够避免在本生灯的明火上加热所引起的感染性物质爆溅。最好使用不需要再进行消毒的一次性接种环。
3.干燥痰液标本时要注意避免生成气溶胶。
4.准备高压灭菌和/或将被处理的废弃标本和培养物应当放置在防漏的容器内(如实验室废弃物袋)。在丢弃到废弃物盛器中以前,顶部要固定好(如采用高压灭菌胶带)。
5.在每一阶段工作结束后,必须采用适当的消毒剂清除工作区的污染。
(四)生物安全柜的使用
1.应参考国家标准和相关文献,对所有可能的使用者都介绍生物安全柜的使用方法和局限性。应当发给工作人员书面的规章、安全手册或操作手册。特别需要明确的是,当出现溢出﹑破损或不良操作时,安全柜就不再能保护操作者。
2.生物安全柜运行正常时才能使用。
3.生物安全柜在使用中不能打开玻璃观察挡板。
4.安全柜内应尽量少放置器材或标本,不能影响后部压力排风系统的气流循环。
5.安全柜内不能使用本生灯,否则燃烧产生的热量会干扰气流并可能损坏过滤器。允许使用微型电加热器,但最好使用一次性无菌接种环。
6.所有工作必须在工作台面的中后部进行,并能够通过玻璃观察挡板看到。
7.尽量减少操作者身后的人员活动。
8.操作者不应反复移出和伸进手臂以免干扰气流。
9.不要使实验记录本﹑移液管以及其他物品阻挡空气格栅,因为这将干扰气体流动,引起物品的潜在污染和操作者的暴露。
10.工作完成后以及每天下班前,应使用适当的消毒剂对生物安全柜的表面进行擦拭。
11.在安全柜内的工作开始前和结束后,安全柜的风机应至少运行5min。
12.在生物安全柜内操作时,不能进行文字工作。
13.通过在生物安全柜内人工产生微生物(枯草杆菌芽孢),在生物安全柜外用培养皿采集枯草杆菌芽孢判定生物安全柜对工作人员的防护能力。
(五)避免感染性物质的食入以及与皮肤和眼睛的接触
1.微生物操作中释放的较大粒子和液滴(直径大于5μm)会迅速沉降到工作台面和操作者的手上。实验室人员在操作时应戴一次性手套,并避免触摸口、眼及面部。
2.不能在实验室内饮食和储存食品。
3.在实验室里时,嘴里不应有东西——钢笔、铅笔、口香糖。
4.不应在实验室化妆。
5.在所有可能产生潜在感染性物质喷溅的操作过程中,操作人员应将面部、口和眼遮住或采取其他防护措施。
(六)避免感染性物质的注入
1.通过认真练习和仔细操作,可以避免破损玻璃器皿的刺伤所引起的接种感染。应尽可能用塑料制品代替玻璃制品。
2.锐器损伤(如通过皮下注射针头、巴斯德玻璃吸管以及破碎的玻璃)可能引起意外注入感染性物质。
3.以下两点可以减少针刺损伤:(a)减少使用注射器和针头(可用一些简单的工具来打开瓶塞,然后使用吸管取样而不用注射器和针头);(b)在必须使用注射器和针头时,采用锐器安全装置。
4.不要重新给用过的注射器针头戴护套。一次性物品应丢弃在防∕耐穿透的带盖容器中。
5.应当用巴斯德塑料吸管代替玻璃吸管。
(七)离心机的使用
1.在使用实验室离心机时,仪器良好的机械性能是保障微生物安全的前提条件。
2.应按照操作手册来操作离心机。
3.离心机放置的高度应当使小个子工作人员也能够看到离心机内部,以正确放置十字轴和离心桶。
4.离心管和盛放离心标本的容器应当由厚壁玻璃制成,或最好为塑料制品,并且在使用前应检查是否破损。
5.用于离心的试管和标本容器应当始终牢固盖紧(最好使用螺旋盖)。
6.离心桶的装载、平衡、密封和打开必须在生物安全柜内进行。
7.离心桶和十字轴应按重量配对,并在装载离心管后正确平衡。
8.操作指南中应给出液面距离心管管口需要留出的空间大小。
9.空离心桶应当用蒸馏水或乙醇(异丙醇,70%)来平衡。盐溶液或次氯酸盐溶液对金属具有腐蚀作用,因此不能使用。
10.对于危险度3级和4级的微生物,必须使用可封口的离心桶(安全杯)。
11.当使用固定角离心转子时,必须小心不能将离心管装得过满,否则会导致漏液。
12.应当每天检查离心机内转子部位的腔壁是否被污染或弄脏。如污染明显,应重新评估离心操作规范。
13.应当每天检查离心转子和离心桶是否有腐蚀或细微裂痕。
14.每次使用后,要清除离心桶、转子和离心机腔的污染。
15.使用后应当将离心桶倒置存放使平衡液流干。
16.当使用离心机时,可能喷射出可在空气中传播的感染性颗粒。
(八)匀浆器、摇床、搅拌器和超声处理器的使用
1.实验室不能使用家用(厨房)匀浆器,因为它们可能泄漏或释放气溶胶。使用实验室专用搅拌器和消化器更为安全。
2.盖子、杯子或瓶子应当保持正常状态,没有裂缝或变形。盖子应能封盖严密,衬垫也应处于正常状态。
3.在使用匀浆器、摇床和超声处理器时,容器内会产生压力,含有感染性物质的气溶胶就可能从盖子和容器间隙逸出。由于玻璃可能破碎而释放感染性物质并伤害操作者,建议使用塑料容器,最好是聚四氟乙烯容器。
4.使用匀浆器、摇床和超声处理器时,应该用一个结实透明的塑料箱覆盖设备,并在用完后消毒。可能的话,这些仪器可在生物安全柜内覆盖塑料罩进行操作。
5.操作结束后,应在生物安全柜内打开容器。
6.应对使用超声处理器的人员提供听力保护。
(九)组织研磨器的使用
1.拿玻璃研磨器时应戴上手套并用吸收性材料包住。塑料(聚四氟乙烯)研磨器更加安全。
2.操作和打开组织研磨器时应当在生物安全柜内进行。
(十)冰箱与冰柜和培养箱的维护和使用
1.冰箱、低温冰箱和干冰柜应当定期除霜和清洁,应清理出所有在储存过程中破碎的安瓿和试管等物品。清理时应戴厚橡胶手套并进行面部防护,清理后要对内表面进行消毒。
2.储存在冰箱内的所有容器应当清楚地标明内装物品的科学名称、储存日期和储存者的姓名。未标明的或废旧物品应当高压灭菌并丢弃。
3.应当保存一份冻存物品的清单。
4.除非有防爆措施,否则冰箱内不能放置易燃溶液。冰箱门上应注明这一点。
5.恒温培养箱的使用最高温度为60℃。
(十一)标本的收集、标记和运输
1.始终遵循标准防护方法,所有操作均要戴手套。
2.应当由受过培训的人员来采集病人或动物的血样。
3.在静脉抽血时,应当使用一次性的安全真空采血管取代传统的针头和注射器,因为这样可以使血液直接采集到带塞的运输管和/或培养管中。用完后自动废弃针头。
4.装有标本的试管应置于适当容器中运至实验室,在实验室内部转运也应这样。检验申请单应当分开放置在防水袋或信封内。
5.接收人员不应打开这些袋子。
(十二)打开标本管和取样
1.应当在生物安全柜内打开标本管。
2.必须戴手套,并建议对眼睛和黏膜进行保护(护目镜或面罩)。
3.在防护衣外面要再穿上塑料围裙。
4.打开标本管时,应用纸或纱布抓住塞子以防止喷溅。
(十三)玻璃器皿和“锐器”
1.尽可能用塑料制品代替玻璃制品。只能用实验室级别(硼硅酸盐)的玻璃,任何破碎或有裂痕的玻璃制品均应丢弃。
2.不能将皮下注射针作为移液管使用。
(十四)用于显微镜观察的盖玻片和涂片
用于显微镜观察的血液、唾液和粪便标本在固定和染色时,不必杀死涂片上的所有微生物和病毒。应当用镊子拿取这些东西,妥善储存,并经清除污染和/或高压灭菌后再丢弃。
三、生物实验室的应急措施
1.刺伤、切割伤或擦伤受伤人员应当脱下防护服,清洗双手和受伤部位,使用适当的皮肤消毒剂,必要时进行医学处理。要记录受伤原因和相关的微生物,并应保留完整适当的医疗记录。
2.潜在感染性物质的食入
应脱下受害人的防护服并进行医学处理。要报告食入材料的鉴定和事故发生的细节,并保留完整适当的医疗记录。
3.潜在危害性气溶胶的释放(在生物安全柜以外)所有人员必须立即撤离相关区域,任何暴露人员都应接受医学咨询。应当立即通知实验室负责人和生物安全官员。为了使气溶胶排出和使较大的粒子沉降,在一定时间内(例如1h内)严禁人员入内。如果实验室没有中央通风系统,则应推迟进入实验室(例如24h)。应张贴“禁止进入”的标志。过了相应时间后,在生物安全官员的指导下来清除污染。应穿戴适当的防护服和呼吸保护装备。
4.容器破碎及感染性物质的溢出
应当立即用布或纸巾覆盖受感染性物质污染或受感染性物质溢洒的破碎物品。然后在上面倒上消毒剂,并使其作用适当时间。然后将布、纸巾以及破碎物品清理掉;玻璃碎片应用镊子清理。然后再用消毒剂擦拭污染区域。如果用簸箕清理破碎物,应当对他们进行高压灭菌或放在有效的消毒液内浸泡。用于清理的布、纸巾和抹布等应当放在盛放污染性废弃物的容器内。在所有这些操作过程中都应戴手套。
如果实验表格或其他打印或手写材料被污染,应将这些信息复制,并将原件置于盛放污染性废弃物的容器内。
5.未装可封闭离心桶的离心机内盛有潜在感染性物质的离心管发生破裂
如果机器正在运行时发生破裂或怀疑发生破裂,应关闭机器电源,让机器密闭(例如30min)使气溶胶沉积。如果机器停止后发现破裂,应立即将盖子盖上,并密闭(例如30min)。发生这两种情况时都应通知生物安全官员。随后的所有操作都应戴结实的手套(如厚橡胶手套),必
要时可在外面戴适当的一次性手套。当清理玻璃碎片时应当使用镊子,或用镊子夹着的棉花来进行。
所有破碎的离心管、玻璃碎片、离心桶、十字轴和转子都应放在无腐蚀性的、已知对相关微生物具有杀灭活性的消毒剂内。未破损的带盖离心管应放在另一个有消毒剂的容器中,然后回收。
离心机内腔应用适当浓度的同种消毒剂擦拭,并再次擦拭,然后用水冲洗并干燥。清理时所使用的全部材料都应按感染性废弃物处理。
在可封闭的离心桶(安全杯)内离心管发生破裂,所有密封离心桶都应在生物安全柜内装卸。如果怀疑在安全杯内发生破损,应该松开安全杯盖子并将离心桶高压灭菌。另一种方法是,安全杯可以采用化学消毒。
四、生物实验室的废弃物处理
生物实验室产生的废液污染主要是化学性污染和生物性污染,另外还有放射性污染,化学性污染包括有机物污染和无机物污染。有机物污染主要是有机试剂污染和有机样品污染。有机样品污染包括一些剧毒的有机样品,如农药、苯并(α)芘、黄曲霉毒素、亚硝胺等。无机物污染有强酸、强碱的污染,重金属污染,氰化物污染等。其中汞、砷、铅、镉、铬等重金属的毒性不仅强,且有在人体中有蓄积性。
生物性污染包括生物废弃物污染和生物细菌毒素污染。生物废弃物有检验实验室的标本,如血液、尿、粪便、痰液和呕吐物等;检验用品,如实验器材、细菌培养基和细菌阳性标本等。生物实验室的通风设备设计不完善或实验过程个人安全保护漏洞,会使生物细菌毒素扩散传播,带来污染,甚至带来严重不良后果。2003年非典流行肆虐后,许多生物实验室加强对SAS病毒的研究,之后报道的非典感染者,多是科研工作者在实验室研究时被感染的。
在对这些污染处理的时候,需要注意以下几个方面:
废液的浓度超过规定的浓度时,必须进行处理。但处理设施比较齐全时,往往把废液的处理浓度限制放宽。最好先将废液分别处理,如果是贮存后一并处理时,虽然其处理方法将有所不同,但原则上要将可以统一处理的各种化合物收集后进行处理。
处理含有络离子、螯合物之类的废液时,如果有干扰成份存在,要把含有这些成份的废液另外收集。
五、生物实验室的消毒和灭菌
消毒和灭菌的基本常识对于实验室生物安全是至关重要的。由于严重污染的物品不能迅速地消毒或灭菌,因此了解预清洁的基本原理也同样重要。关于消毒和灭菌,以下基本原则适用于所有已知不同级别的微生物病原体。
关于清除污染的特殊要求,要根据实验工作的类型以及所操作的感染性物质的特性来决定。这里所提供的一般性资料,可用于建立标准的和更专门的程序,以处理特定实验室中所涉及的生物危害。消毒剂的作用时间因具体的品种和生产商而不同。因此,所有消毒剂使用的推荐意见均必须遵守生产商的说明。
1.定义关于消毒和灭菌有许多不同的术语,下面是生物安全中较常用的:
抗菌剂(antimicrobial)能够杀死微生物或抑制它们生长和繁殖的制剂。
防腐剂(antiseptic)能够抑制微生物生长和繁殖但不足将其杀灭的物质。防腐剂经常应用于体表。
生物杀灭剂(biocide)所有能够杀死生物体的制剂的统称。化学杀菌剂(chemicalgermcide)用于杀死微生物的化学品或化学混合物。清除污染(decontamination)去除和/或杀死微生物的任何过程。该词也用于去除或中和有危害的化学品和放射性物质。消毒剂(disinfectant)用于杀死微生物的化学品或化学混合物,但不一定杀死其孢子。消毒剂常用于非生命物体或其表面。消毒(disinfection)杀死微生物的物理或化学手段,但不一定杀死其孢子。灭菌剂(microbicide)能够杀死微生物的化学品或化学混合物。该词常常可以代替“生物杀灭剂”、“化学杀菌剂”或“抗菌剂”。
杀孢子剂(sporocide)用于杀死微生物和孢子的化学品或化学混合物,灭菌(sterilization)杀死和/或去除所有微生物及其孢子的过程。
2.实验室材料的清洁
清洁是指去除污垢、有机物和污渍。清洁方法包括刷、吸、干擦、洗涤或用浸泡肥皂水或清洁剂的湿墩布拖擦。尘土、污物以及有机物是微生物的栖身之所,并可能影响除污染剂(抗菌剂、化学杀菌剂以及消毒剂)的杀菌作用。
必须通过预清洁才能实现消毒和灭菌的目的。许多杀菌剂只对经过预清洁的物品才具有杀菌活性。预清洁时必须小心,以避免暴露于感染性物质。
预清洁时必须使用与以后使用的杀菌剂化学上相容的物质。非常普遍的是采用相同的化学杀菌剂进行预清洁和消毒。
3.化学杀菌剂多种化学品可以用作消毒剂和∕或防腐剂。由于其数量与种类还在不断增加,因此,要根据具体的用途认真选择。许多化学品在较高温度时其杀菌效果更快也更好。但同时,较高的温度能够加速其挥发和降解。因此在热带地区,由于室温较高,可能缩短化学杀菌剂的有效期,在使用和储存这些化学品时要特别注意。
许多杀菌剂对人或环境有害,应当按生产商的说明小心地进行选择、贮存、操作、使用和废弃。为了个人的安全,建议在稀释化学杀菌剂时应戴手套、围裙和保护眼睛的器具。
化学杀菌剂一般不用于地面、墙壁、设备和家具的常规清洁。但是,在控制疾病暴发时可以使用。正确使用化学杀菌剂可以确保实验场所的安全,减少来自感染性物质的危险。只要可能,出于经济原因、控制库存以及限制环境污染等的考虑,应尽可能控制所使用化学杀菌剂的量。
生物实验室常见的化学杀菌剂有以下几种,使用时,要仔细查阅其用途及使用范围,严格按用途及用量使用:
氯(次氯酸钠)
二氯异氰尿酸钠
氯胺
二氧化氯
甲醛
戊二醛
酚类化合物
季铵盐类化合物
乙醇
碘和碘伏
过氧化氢和过氧乙酸
4.清除局部环境的污染
需要联合应用液体和气体消毒剂来清除实验室空间、用具和设备的污染。清除表面污染时可以使用次氯酸钠(NaOCl)溶液;含有1%有效氯的溶液适于普通的环境卫生设备,但是当处理高危环境时,建议使用高浓度(5g/L)溶液。用于清除环境污染时,含有3%过氧化氢的溶液也可以作为漂白剂的代用品。
可以通过加热多聚甲醛或煮沸福尔马林所产生的甲醛蒸气熏蒸来清除房间和仪器的污染。这是一项需要由专门培训的专业人员来进行的、非常危险的操作。产生甲醛蒸气前,房间的所有开口(如门窗等)都应用密封带或类似物加以密封。熏蒸应当在室温不低于21℃且相对湿度70%的条件下进行(见本章“清除生物安全柜的污染”部分)。
清除污染时气体需要与物体表面至少接触8h。熏蒸后,该区域必须彻底通风后才能允许人员进入。在通风之前需要进入房间时,必须戴适当的防毒面具。可以采用气态的碳酸氢铵来中和甲醛。采用过氧化氢溶液对小空间进行气雾熏蒸同样有效,但需要专门的蒸气发生设备。
5.清除生物安全柜的污染
清除Ⅰ级和Ⅱ级生物安全柜的污染时,要使用能让甲醛气体独立发生、循环和中和的设备。应当将适量的多聚甲醛(空气中的终浓度达到0.8%)放在电热板上面的长柄平锅中(在生物安全柜外进行控制)。然后将含有比多聚甲醛多10%的碳酸氢铵置于另一个长柄平锅中(在生物安全柜外进行控制)。在柜外将该平锅放置到第二个加热板上,在安全柜外将电热板接上插头通电,以便需要时在柜外通过开关电源插头控制盘子的操作。如果相对湿度低于70%,在使用强力胶带[如管道胶带(ducttape)]密封前部封闭板前,还要在安全柜内部放置一个开口的盛有热水的容器。如果前部没有封闭板,则可以用大块塑料布粘贴覆盖在前部开口和排气口以保证气体不会泄漏进入房间。同时供电线穿过前封闭板的穿透孔须用管道胶带密封。
将放有多聚甲醛平锅的加热板插上插头接通电源。在多聚甲醛完全蒸发时拔掉插头以断电。使生物安全柜静置至少6h。然后给放有第二个平锅的加热板插上插头通电,使碳酸氢铵蒸发。然后拔掉电插头,接通生物安全柜电源两次,每次启动约2秒钟来让碳酸氢铵气体循环。在移去前封闭板(或塑料布)和排气口罩单前,应使生物安全柜静置30min。使用前应擦掉生物安全柜表面上的残渣。
6.洗手/清除手部污染
处理生物危害性材料时,只要可能均必须戴合适的手套。但是这并不能代替实验室人员需要经常地、彻底地洗手。处理完生物危害性材料和动物后以及离开实验室前均必须洗手。
大多数情况下,用普通的肥皂和水彻底冲洗对于清除手部污染就足够了。但在高度危险的情况下,建议使用杀菌肥皂。手要完全抹上肥皂,搓洗至少10秒钟,用干净水冲洗后再用干净的纸巾或毛巾擦干(如果有条件,可以使用暖风干手器)。
推荐使用脚控或肘控的水龙头。如果没有安装,应使用纸巾或毛巾来关上水龙头,以防止再度污染洗净的手。如上所述,如果没有条件彻底洗手或洗手不方便,应该用酒精擦手来清除双手的轻度污染。
7.热力消毒和灭菌
加热是最常用的清除病原体污染的物理手段。“干”热没有腐蚀性,可用来处理实验器材中许多可耐受160℃或更高温度2~4h的物品。
煮沸并不一定能杀死所有的微生物或病原体,但如果其他方法(化学杀菌、清除污染、高压灭菌)不可行或没有条件时,也可以作为一种最起码的消毒措施。灭菌后的物品必须小心操作并保存,以保证在使用之前不再被污染。
使用高压灭菌器时:灭菌器腔内装载要松散,以便蒸汽作用均匀;灭菌器的排水过滤器应经常拆下清洗;待温度降至80℃以下时才能打开。高压蒸汽灭菌是对实验材料进行灭菌的最有效和最可靠的方法,确保正确灭菌的条件是121℃、灭菌15分钟而干热灭菌使用温度和时间通常为160-400℃,1-5h;采用熏蒸法灭菌,熏蒸过程至少密闭保持12h;液体和固体物品分开存放。
被病原微生物污染的玻璃器皿,应先放在高压灭菌锅中进行消毒灭菌。用玻璃(细菌)滤器过滤含传染性物质时,应先在2%的石炭酸溶液中至少浸泡2h,然后再洗涤、高压灭菌。湿热灭菌较干热灭菌消毒效果更好,使用也较普遍;使用湿热灭菌时,蛋白质在含水多时容易变性,易于凝固;使用湿热灭菌时,蒸汽具有潜热,当蒸汽与被灭菌的物品接触时,可凝结成水而放出潜热,使温度迅速升高,加强灭菌效果。
8.紫外线杀菌
紫外线消毒方便实用,紫外灯可以是固定式,也可以是活动式的,但离被照射物不应超过1.2M,开启的紫外灯时不可以在紫外灯下工作。紫外线消毒时不能同时开启日光灯和紫外灯;紫外线消毒方便实用,但不能彻底灭菌,特别是对细菌的芽孢杀灭效果较差。
